はじめに
(2016.7.23~)
近年のライフサイエンス研究は、コンピューターの発展に伴う高速情報処理技術により、一度に大量のデータを処理し蓄積することが可能となりました(データベース化)。これにより大規模な網羅的解析を行う手法が急速に発展しましたが、中でも蛍光色素を利用し画像解析処理技術を応用する装置や細胞を検出する装置(次世代シーケンサー、ハイコンテンツスクリーニングスキャナーやセルアナライザー)と質量分析技術を応用した装置が様々な分野で用いられ、ライフサイエンス研究の興隆に大きく貢献しております。これらは今後の1細胞研究でも切り離せない技術として注目をすべきものです。
その中でも最も注目するものとして次世代シーケンス技術を例に挙げます。次世代シーケンサー(第2世代と呼ばれるもの)は日本国内では2007年から発売が開始されており、
・ロシュ(454 Life Sciences を2007年3月に買収)
・アプライドバイオシステムズ<現ライフテクノロジーズ>(Agencort Bioscience Corporation を2006年5月に買収)
・イルミナ(Solexa を2006年5月に買収)〔1〕
の順にリリースされ、リード長やタグ数の改良が加えられながら、各社新製品をリリースし、更なる改良は主にDNA1分子を鋳型とする第3世代シーケンサーに引き継がれ今に至ります。この技術を用いることで1細胞内における各々の遺伝子発現量が以前の技術(マイクロアレイ等)に比べ精密に分かるようになり、様々なステージで個々の細胞間の遺伝子発現レベルに大きなばらつきがあることが分かってきました。
この次世代シーケンサーの出現により、1細胞の事細かな情報が分かるようになりましたが、無作為に1細胞ずつを調べていっても非効率であるため、何かしらの指標を元にして、その細胞を選択的に回収(Focused Picking)し、その後に別の解析技術を用いて調べる必要性が出てきており、このようなニーズに答えるべく国家レベルで1細胞に関係する研究プロジェクトがいくつも立ち上がり(図1)新しい1細胞での解析手法などが出現しつつあります。
図1 1細胞に関係する主な研究プロジェクト
1細胞研究による様々な課題の解決 ~生命の真理を追求する~
当社や上述したプロジェクトに参画する研究者は、1細胞の研究から現在日本が抱える様々な問題を解決できると考えております。
【病気の解明:がん、糖尿病、アレルギー、アルツハイマー、不妊、難病】
【病気の治療方法:iPS、創薬(抗生物質・バイオ医薬品)、免疫療法】
【診断:CTCs、マラリア、寄生虫感染、ウイルス感染、胎児有核赤血球】
【環境エネルギー:オイル生産菌、メタン発酵菌、セルロース分解菌、汚水処理・環境浄化菌】
【生産性向上:食品、農産物、医薬品、酵素】
【医療費の削減:病気の解明、治療方法の改善、創薬のコストダウン】
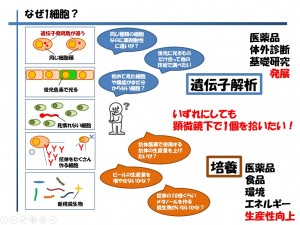
1細胞-遺伝子解析
1細胞とひとことで言っても、生物は種類が多様であるため、各生物の各細胞種によって研究対象が異なります。しかしながら、いずれの場合でも顕微鏡観察下で1個ずつ拾う(1細胞ピッキング)する必要性があり、その後に行うことは「遺伝子解析」もしくは「培養」となります(図2)
図2 様々な1細胞のニーズ
遺伝子解析の手法としては調べたい対象の遺伝子が分かっている場合は、1個の細胞を直接PCRtubeやPCRcapに移したり、Single cell PCR用スライドグラスの上に落とし、細胞の可溶化→逆転写の工程を経てリアルタイムPCRを行うか、次世代シーケンサーを用いて解析を行います。これに対し、機能がまだよく分からない細胞の遺伝子発現にあたりを見出したい場合やゲノムを調べたい、あるいはエピジェネティックな作用を調べたいという場合には、何かしらの指標(顕微鏡観察での外見的な特徴や蛍光の有無)で細胞を判別し、少なくとも10個以上同じ指標で細胞を拾い上げ、マイクロアレイや次世代シーケンサーを用いて解析を行う事になります。
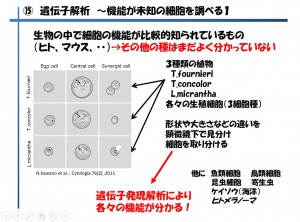
機能がまだよく分かっていない細胞の機能解明については、植物の受精メカニズムを調べるために植物の受精に関係する数種類の細胞を、10~20個体のめしべをばらして1個体から細胞1個ずつを拾い集め遺伝子発現を解析した例を挙げます(図3)〔2〕
図3 機能が未知の細胞を調べる
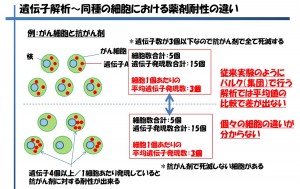
次に最近の1細胞研究でよく聞くようになった「不均一性」について「がん細胞と抗がん剤」を例に説明します(図4)
図4 細胞の不均一性
ある1個の細胞内で遺伝子Aが3つ発現しているとします。3つ遺伝子Aを持っている細胞に対して、抗がん剤がある濃度で効果を発揮し死滅させることが出来たとすると、上段の細胞5個はすべて死滅することになります。それに比べ下段の5個のうち、遺伝子数が4つや5つの細胞は生存し増殖していくため、やがては培養後に残ったすべての細胞が抗がん剤に耐性を持っていることになります。この原因が何から由来しているのかを調べようと上段と下段の細胞集団について遺伝子発現の比較を行おうとしたとき、上段の遺伝子発現数の合計は15個であり、下段も同数となる。となると集団対集団で比較をしても違いを見いだすことができないという事になります。このように従来の遺伝子発現解析研究では、遺伝子発現数を平均化してしまっており、違いを見出すことが出来ていないケースがあると考えています。
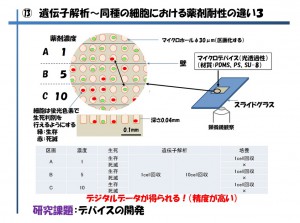
現在「不均一性」が起こる理由はがん幹細胞に由来し、増殖に伴い性質が異なる細胞が複数出来てくる事が原因だと言われていますが、これらの不均一性の研究を行うにあたり、マイクロデバイスを用いた手法が最近ではよく見受けられるようになりました(図5)
図5 マイクロデバイスを用いた手法
マイクロデバイスとはナノテクノロジーを用いて金型に微細構造加工を施し、プラスチックなどに転写したマイクロスケール構造の容器の事を差します。中には容器ではなく流路構造の物などもありますが、このようなマイクロデバイスを用いる手法が有効な理由は、
①マス目状に区画化されているため、細胞1個ずつをナンバリングしやすい(A1、B2等、ウェルプレートの座標と同様)
②個数を数えやすい
③ひとつのデバイスで一度に複数の薬剤濃度を検討でき、更に微量化することでコスト削減につながる
④1細胞ずつを判別し、目的の細胞のみを採取し易くする
図5で用いているマイクロデバイスは1つのデバイスに数万~数百万個のマイクロホール(直径30μmの穴)が開いている物です。
細胞を分散させた溶液をマイクロデバイス上にふりかけデバイスをゆすると、元々1つの穴の大きさを細胞1個より少し大きめに設計しているため、1個/1穴が無数に出来上がります。そこに対してある程度の数ごとに設計してあった壁を境界にして、薬剤の濃度に勾配をつけ、それぞれの細胞に対する薬剤の感受性(この場合生死判別)を調べます。蛍光色素で生死判別を行った後、各濃度における生存した細胞と死滅した細胞との遺伝子解析による比較や濃度間による比較を行ったり、生存した細胞のいくつかを、その後の評価のため1個ずつ取り出し培養(クローニング)を行います。この時に重要なのは、薬剤濃度が低い容器内で死滅している細胞は「非常に弱い」ということ、逆に薬剤濃度が高い容器内で生きている細胞は「非常に強い」ということになり、この状態のときに各々の細胞を回収し比較することでダイナミックな差異が見いだせられるのではと考えています。
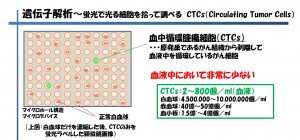
マイクロデバイスを用いた手法はCTCs(血中循環腫瘍細胞)の研究分野でも多く使われています(図6)
図6 蛍光で光る細胞を拾って遺伝子解析を行う(CTCs)〔3〕
CTCs(血中循腫瘍細胞)は原発巣であるがん細胞から剥離して血液中を循環しているがん細胞ですが、血液中において非常に少ないため、検出をすることが困難です。しかしながら、がん患者から採取した血液中におけるCTCsの個数を正確に把握できるようになると、抗がん剤投与の必要性を判断する材料につながります。現在認可され医療現場で使用されている機器では感度が十分でないと言われており、より感度の高い検出方法や装置の開発を多くの企業・大学が行っています。
先に挙げたマイクロデバイスの特徴にあるように、区画化されていると1度見つけた細胞をナンバリング(マッピング)して電動ステージなどで位置記憶することが出来るため、CTCsのようなレアな割合でしか見つからない細胞を扱う時に一度見つけた細胞を見失わないという意味では好都合となります。
現在はCTCsを拾い取り、遺伝子解析をすることで転移の源になっている臓器を判別するためのマーカー探索などを行ったり、高感度検出方法を探るためCTCs自身の新しいマーカーを探したりすることが研究されています。
1細胞-培養
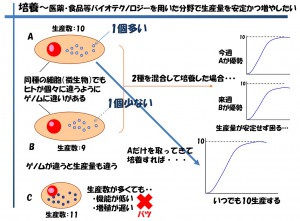
バイオ医薬品や抗体医薬品の研究・生産分野で必ず行う業務の一つに細胞選抜とクローニングがあります。モノクローナル抗体を生産するハイブリドーマは1個の細胞ごとに増殖能と抗体生産量が異なりますが、これら能力の異なる細胞を仮に混ぜて培養し、生産に持っていった場合、生産の安定性や抗体力価(抗体価)の安定性に問題が生じます(図7)
図7 医薬品・食品などの生産量を安定に、かつ増やしたい
無数の細胞から1個のチャンピオンとなる細胞を選抜するまでには多くのコストと手間がかかっています。一般的な方法としては、1細胞化(限界希釈法)/培養/コロニーの顕微鏡観察/イムノアッセイ(ELISA、ウエスタンブロッティング)/主にはこれらの繰り返しとなります。原価希釈法を用いた1細胞化について、どの位の数を行うかは、その研究機関や担当者の判断となりますが、96ウエルプレートで10~30枚(約1000~3000個)ほど行われているケースが多く見受けられます。最近はコロニーの顕微鏡観察を数十枚分全自動で行える装置なども市場に存在するが、高額であるため普及は進んでいない状況です。
これに置き換わる一番シンプルかつ正確な方法は、1個の細胞が分泌する抗体量や力価を指標にして、その細胞を回収しウェルプレートへ直接正確に吐出する事ですが、前述の研究プロジェクトからの成果やマイクロデバイスを用いた新手法にブレークスルーを期待する所です。
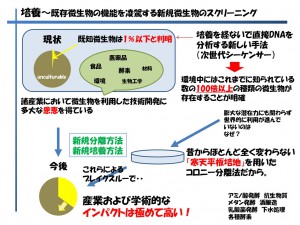
話は変わりますが1細胞研究の発展を一番待ち望んでいるのは、もしかすると微生物を扱っている研究者かもしれません。日本は元々、醗酵の文化が根付いており諸産業において微生物を利用した醗酵技術に多大な恩恵を受けてきました。ところが近年は微生物から生み出される新規化合物が極端に低下し、特に各企業での微生物研究が以前に比べ衰退してしまいました。その理由は有用微生物が取りつくされたという事ではなく、微生物の分離方法と培養方法が100年以上前のコッホの時代から変わらない寒天平板培地を用いた手法だからです(図8)
図8 既存微生物の機能を凌駕する新規微生物のスクリーニング
冒頭で述べましたが、次世代シーケンサーの登場により従来に比べ調べたい対象サンプルの中に存在する遺伝子量や配列がより精密に分かるようになったのは微生物研究でも同様となります。
土壌中の微生物の全ゲノムを次世代シーケンサーで調べますと、既知とされている微生物が0.1%にも満たず、また、海洋中に至っては0.001%に満たないことも証明されています〔4〕 ということは環境中にはこれまでに知られている数の100倍以上の種類の微生物が存在することが明確にもかかわらず、この膨大な潜在力を世界各国が利用できていないという事が分かります。
例えば新規微生物探索のために行われてきた寒天平板培地上に土壌溶液を振りまくという行為は、微生物を人間に例えると硬くて冷たい氷の上にライオンや毒グモやあらゆる恐ろしい生物がうじゃうじゃいる中に、裸で放り出され「さあ、生き抜いてみなさい!」と言っているようなものではないでしょうか。強敵を排除し(1細胞にすること)、適正な環境(培養条件)を作ってあげることで新規微生物が連続して発見され、産業界にも学術的にも非常に大きなインパクトを与えると考えています。
ただ、微生物の場合、光学顕微鏡観察をなされたことがある方ならお分かりだと思いますが、哺乳類の細胞より遥かに小さく、泳ぎ回るものも非常に多いのが特徴です。また微生物1匹を回収しようとガラス製の微細管を近づけると、その勢いで目的の微生物が流れてしまい見失ってしまう事がほとんどとなります。そこでいくつかの研究機関ではドロップレット内に微生物を封入する方法を提案しています。
ドロップレットは単純なエマルジョン構造の場合と、寒天やアルギン酸などを水溶液中に混ぜておいたゲルマイクロドロップとが存在します。どちらの場合も、水溶液中に希釈した微生物溶液を混ぜ、温めたオイルにその水溶液を滴下し分散(ミキサー法、マイクロ流路法)させることで、オイル中に無数の水のドロップ(球状)が出来上がります。この時に希釈して混ぜた微生物の数より、出来上がるドロップの数が上回れば、確立的に1ドロップ内に微生物が1匹入った物がたくさん出来上がりますので、このようにドロップ構造にしたものを回収することで、先に挙げたような微生物回収時に見失ってしまう問題を解決することが可能となります。(2016.10.20)
社会保障費の削減に向けて
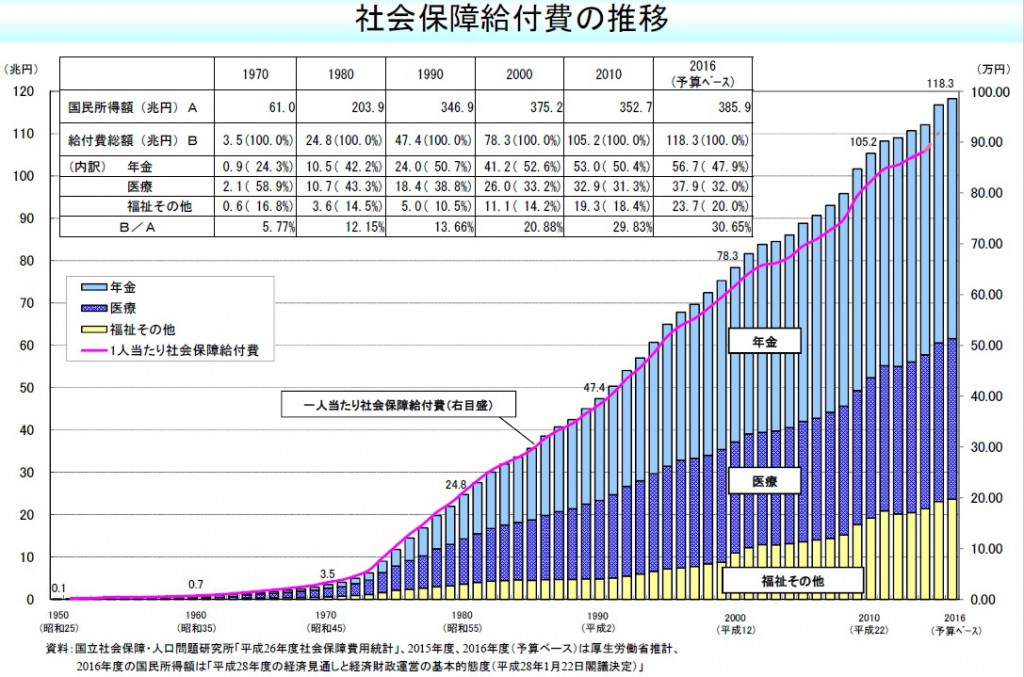
日本国内における最大の課題として社会保障費(社会保障給付費)の大幅な増加が挙げられます(図9)〔5〕
図9 社会保障給付費の推移(厚生労働省)
この内訳は、年金・医療・福祉(介護等)など、となりますが、病気を早期に完治させることで医療費の削減と福祉関連費(介護が必要なくなる、健康に働ける人を増やし生活保護費を減らす)を削減することができます。年金については別途、地方移住などの対策が必要です。
この社会保障費の増加に関わるものとして、最初に「不妊」の事象を挙げます。
不妊は少子化や社会保障費の負担増と家族間のQOLに関わる大きな日本の社会問題と考えられます。
2014年9月時点での記事内容(図10)を見ますと、2012年に行われた日本国内の年間体外受精回数は32万6千回にのぼり、うち出生数は3万7953人という報告が日本産婦人科学会からなされています。
図10 2012年の体外受精回数と出生数(日本経済新聞)
記事には「晩婚化に伴い加齢による不妊に悩む女性が増えていることが原因とみられる」とあります。
その後、2016年9月時点での日本経済新聞の記事内容では2014年に実施された年間体外受精回数は39万3745回、出生数は4万7322人となり、また2015年実施の速報値ではこの年間体外受精回数が45万回を超えています。いずれにしましても体外受精における出生の成功率は10%超ということが分かります。
また、体外受精児は年間全出生数の1/21となり、1学級に2人の割合となっています。
先の新聞記事の内容からも分かるように、以前から女性だけの問題と捉えられている「不妊」は体外受精を行うクリニックでは、以前から男性側が原因であるケースも多く見られることが言われており、平成27年度からは男女ともに原因があることを前提にした不妊の調査が行われております〔6〕
不妊治療(凍結胚移植=体外受精)は厚生労働省が特定治療支援事業として認定し、給付金の補助があり、2011年(平成23年度)には11万2千件を超える支給実績がありました(図11)
図11 特定治療支援事業の給付実績
体外受精案件の約40%に該当します。このデータから推測される2015年時の負担費用については以下のようになります。
<国内における個人負担の合計>
20万円/1件 x 45万回/1年 = 900億円
<国や自治体が行う負担の合計>
15万円/1件 x 18万回/1年 = 270億円
患者の経済的な負担が大きいことが推測されます。もちろん精神的な負担も存在するのは言うまでもありません。
このような少子化と不妊という背景のもと、体外受精専門のクリニックが新設されたり、従来の産婦人科がこれらに切り替わるなどして、現在は全国に560か所の体外受精クリニックが存在します。体外受精に関係する技術や研究も年々新しいものが提案されて導入されてきています。
しかしながら、このような政府の政策や各社からの新技術の導入が体外受精を助長しているという事実も存在し、一向に上がらない体外受精の成功率(10%)や不妊のメカニズムを解明する研究はデータとして拾えないほど研究がなされていないという現状があり、医学部でも不妊研究を行う研究室や講座が非常に少なく、根本的な解決に対して予算が投じられていないことが課題として挙げられます。
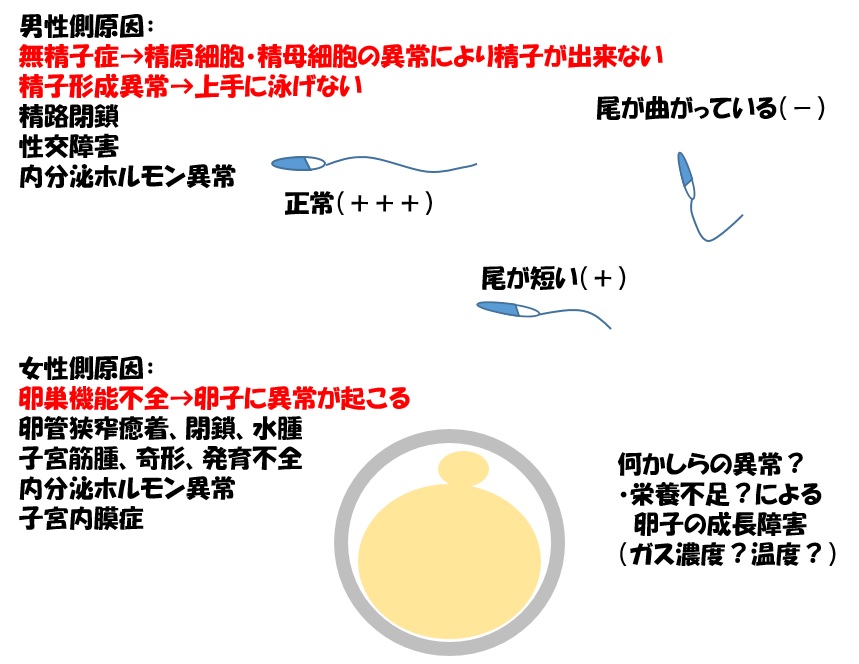
男性側の主な不妊原因は無精子症と精子形成異常となり、特に精子形成異常のうち尾の形状に異常がある場合が多く見られます。
女性側の主な不妊原因は卵巣機能低下や機能不全となり、これにより卵子の成長障害が起こります(図12)
図12 不妊の男性側原因と女性側原因
通常ヒト細胞の培養最適温度は37℃で、受精卵の場合も同様に37℃ですが精子形成に関与する精巣組織内の細胞(精原細胞、精母細胞、精細胞等)はこれより数℃低温(30~34℃)での培養が最適条件となります。通常のヒト細胞培養と同じと考えれば温度・栄養・O2・CO2ガス濃度が重要な要素となりえますが、これらの要素を体内で精巣組織や卵巣組織に供給しているのは「血液」になります。
これらのうち、不足すると致命的な要因になる順番はヒト個体の場合、ガス濃度>温度>栄養になります。これは神経細胞が酸素欠乏状態に敏感でダメージを受けやすいことが原因として知られており、脳機能がダウンすることで生命活動を維持できなくなるからです。しかしながら、培養におけるヒト細胞ではガス濃度の変化に対して耐性がある細胞種も多く、その種類によって特徴が変わります。また2~3℃の温度変化や微妙な栄養状態(血清濃度・イオン濃度等)によって増殖が抑制されることもあります。あるいは同種の細胞であっても培養ステージによって(例えば細胞分裂期など)求められる要素が変化することも考えられます。
現在は顕微鏡上でのCO2培養装置や培地などを循環する培養装置も開発されており、上述の要素を少しずつ変化させながら、細胞の状態を長時間(数十時間)において観察することが可能となりました。このような装置や器具を用いる事で精子形成や卵子の成長などを観察しながら、人が社会活動を行う上で考えられる様々な刺激(アルコール、薬剤、食品)を与えたり、形状の違いや変化のタイミングでピッキングして、より詳細な情報を調べることなどが原因解明に必要だと考えています。
このような研究を行うとき、ヒトから実験対象サンプルを入手することは難しいため、家畜からサンプルを入手し研究することが不可欠となります。ウシやブタを用いた繁殖の研究を行う畜産関係の研究者とヒト生殖関係の研究者が共働し、ここに研究予算を投じることが大切です。これにより不妊のメカニズムを解明し、自然受胎数を増やすことで体外受精件数が減り、医療費の削減につなげることが可能となります。
次に創薬研究における研究費削減について述べます。(2017.5.8)
<創薬研究費のコストダウン>
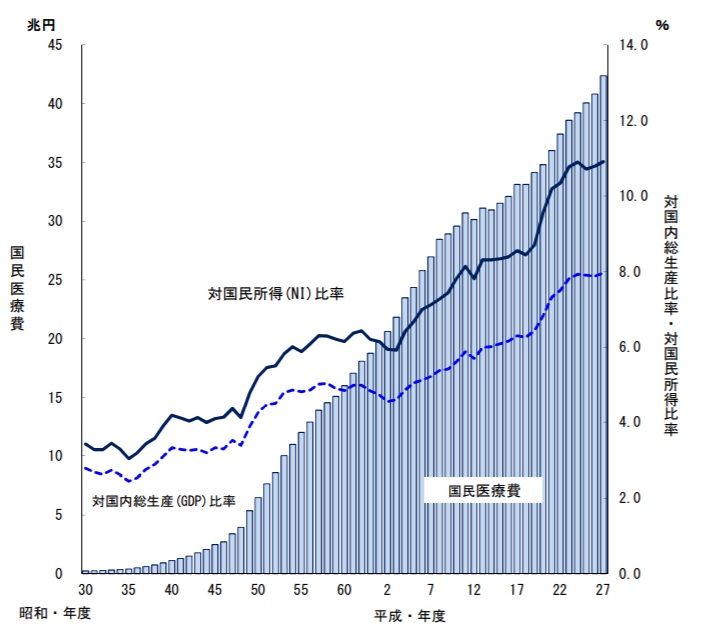
日本は20年以上にわたり国民所得が増加しない中、医療費は上昇傾向にあります(図13)
図13 国民医療費の推移(対国民所得・対GDP)(厚生労働省_平成27年度_国民医療費の概要)
平成27年度において医療費は所得に対して約11%となり、これは年収500万円の人が、その所得のうち55万円/年を医療に費やしている計算となります。
医療費が上昇している理由は様々ですが、この上昇を抑えるため厚生労働省は全体的に薬剤費を下げる検討を始めています。
今まで薬剤費は上昇をし続け、個別の薬剤も非常に高価な物が増えましたが、上げざるをえない根本的な理由も存在します。
①国産メーカーが開発した薬剤のシェアが落ち込み、海外メーカーからの輸入に依存し始めたこと
②厚生労働省が認可する新薬について、効果が思うように上がらないため、更に治験患者数を増やさなければならず費用がかさむ
③創薬研究に用いる設備や器材、消耗品などのほとんどが海外に特許を抑えられており、輸入品としての購入費用がかさむ
などが主な理由です。
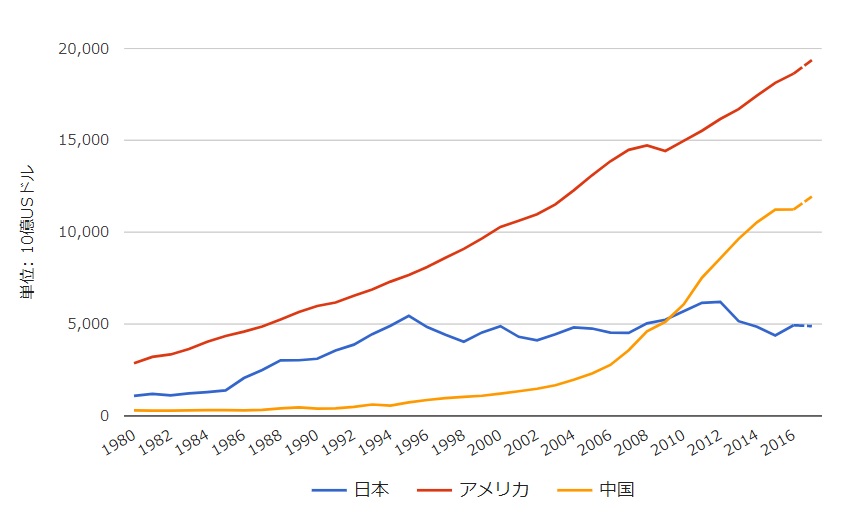
上述したように日本のGDPが20年にわたり増加せず、特にドル建てでは減少するなか、海外の先進国や中国、インドなどはそれなりにGDPが伸び、どの国も所得も物価も上がっているため、日本だけが毎年負担割合が増える構図となっています(図14)
図14 名目GDPドル建て_日本/アメリカ/中国の推移(世界経済のネタ帳より)
この輸入依存を打開するために、日本独自の技術のみで創薬基盤を構築できるようなプロジェクト〔7〕も設立しましたが、国産のシェアを伸ばすにはまだ時間がかかります。
話は変わりますが、創薬研究において細胞培養実験は薬剤の効果や毒性の評価を行う上で欠かせないものとなっています。
25年ほど前までは細胞培養実験は主に角フラスコやシャーレで行われていました。しかしながらマイクロウェルプレートが市場に出始めるとそれはすぐに広まり、96well、48well、384wellなどのプレートを用いる方法がスタンダードとなりました。すぐに受け入れられた理由は、場所を取らずに多検体処理ができ、培地や薬剤の使用量が減りコストが下がったからです。
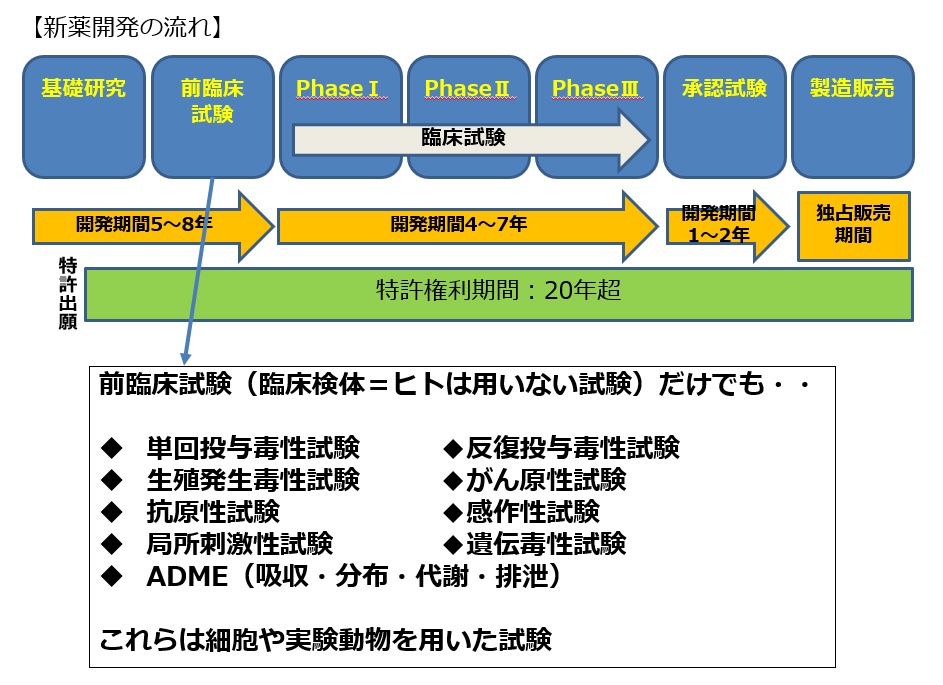
このように容器を多検体処理ができるものに変更したにも関わらず、現在製薬企業が開発中の薬剤の効果や毒性の評価で求められる試験項目は非常に多く、更に膨大な数をこなさなければなりません(図15)
図15 前臨床試験における試験項目
このような課題を解決する方法として、大幅なコストダウンに向け、1細胞研究手法とマイクロデバイスを用いる方法が開発されています(図16)
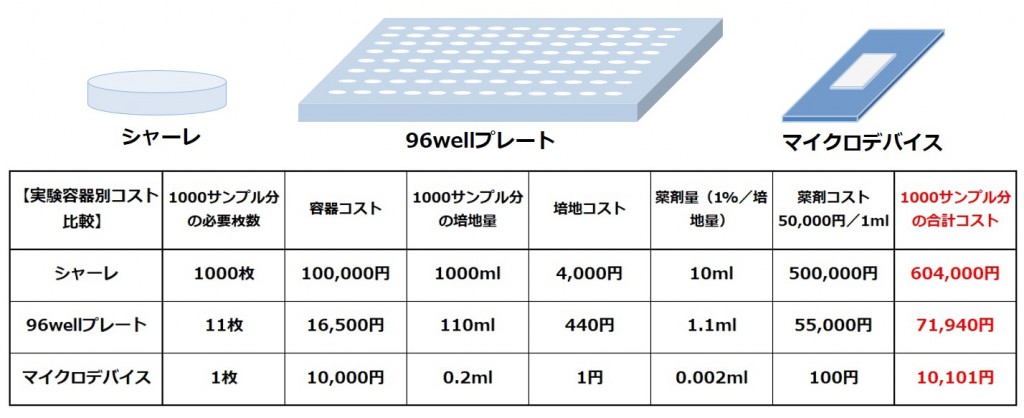
図16 容器別のコスト比較
図にありますように、容器のボリュームを微小化することでコストダウンにつながりますが、容器や培地は国産メーカーが存在し価格も安定しているため費用対効果はそれほど高くありません。効果が高いのは研究試薬や薬剤の費用です。
研究で用いる薬剤のうち、バイオ医薬品などは自社にて生産したり外注により調達しますが、これも関係費用が高価となります。また阻害剤などは特に多くを海外メーカーに特許で抑えられているため費用が高くなります。
図16ではマイクロデバイス1枚当たりのサンプル数を1000サンプル分で計算をしておりますが、実際にはマイクロデバイス1枚当たりに数万wellを成型することが実現しており、1サンプル=1細胞の概念と合わせて新しい実験系を作り出すことで更なるコストダウンを目指すことが可能です。
ここでマイクロデバイスを改めて説明いたします。
マイクロデバイスとは金属などに微細構造加工を施し、プラスチックやシリコーンゴムなどに転写したマイクロスケール構造の容器を指します。中には容器ではなく流路構造の物もあります。
マイクロデバイスを用いるメリットは
① マス目状に区画化されているため、細胞1個づつをナンバリングしやすい(ウェルプレートの座標と同様:A1、B2など)
②個数を数え易い
③ひとつのデバイスで一度に複数の薬剤濃度が検討でき、更に微量化することでコスト削減につながる。
④1細胞ずつを判別し、目的の細胞のみをピッキングしやすくする。
⑤1細胞ずつの試験結果を(0;1)のデジタルデータとして取得することが出来るため、従来行われてきた集団の平均データと比較した場合に、格段にデータの精度が上がる。
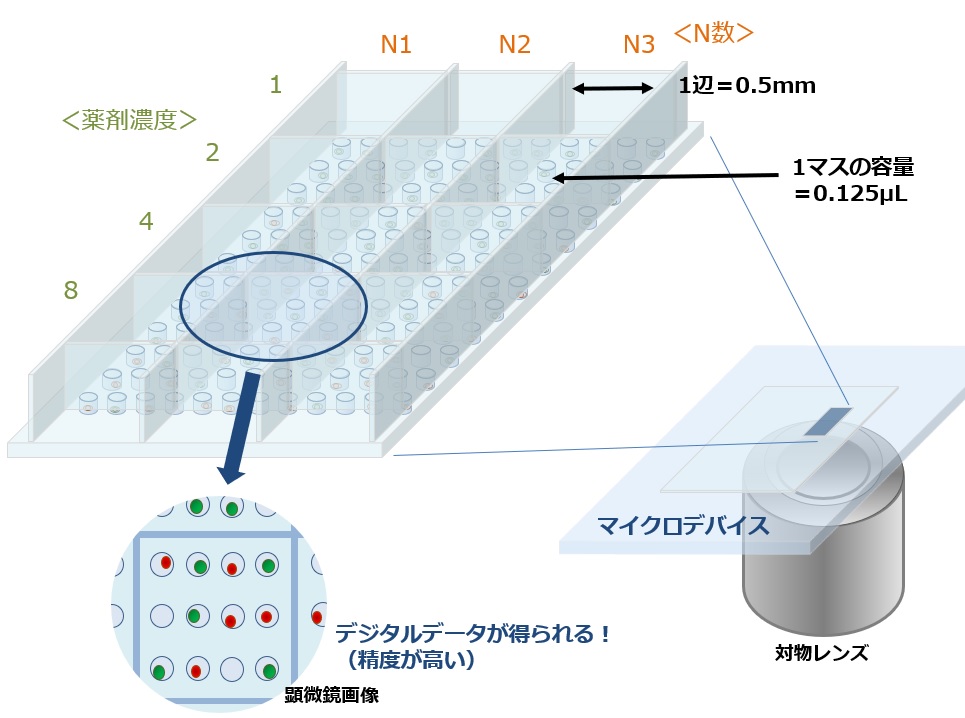
図17では薬剤の濃度を4種類、N数=3 の実験例を示していますが、この図中では1well(円筒形の穴)のサイズがφ0.05mm、1マス(四角形)のサイズが1辺=0.5mm を想定しているため、培地量は1マス=0.125μL x 12マスで全量1.5μLのスケールとなります。
図17 マイクロデバイスを用いた薬剤スクリーニング
<オルガノイド ~臨床試験の代替法~>
オルガノイドは自己組織化によりin vitroで3次元構造をとる小さな臓器です。ヒトiPS細胞作製が可能となり、近年ではオルガノイドの作製も、より身近なものとなりました。このヒト細胞由来のオルガノイド〔8〕を用いる事で今まで創薬研究において実験動物でしか行えなかった前臨床試験のうち、特に毒性予測の分野では非常に効果が高いと考えられ、実験動物利用の大幅な減少とその後の臨床試験における成功確率の上昇が期待できます。
一般的なオルガノイドの大きさは0.3~1mmほどとなり、従来の実験のハンドリングと比べるとかなり小さくなるため、この場合も前述のようなマイクロデバイスを用いた実験手法が効果を発揮します。オルガノイドの作製からスクリーニングまでを一つのマイクロデバイス上で行うことが、直近の課題と考えています。
<病気の解明 ~リアルタイムモニタリングとLive Cell Pickの重要性>
ここで改めて1細胞研究の必要性について述べます。
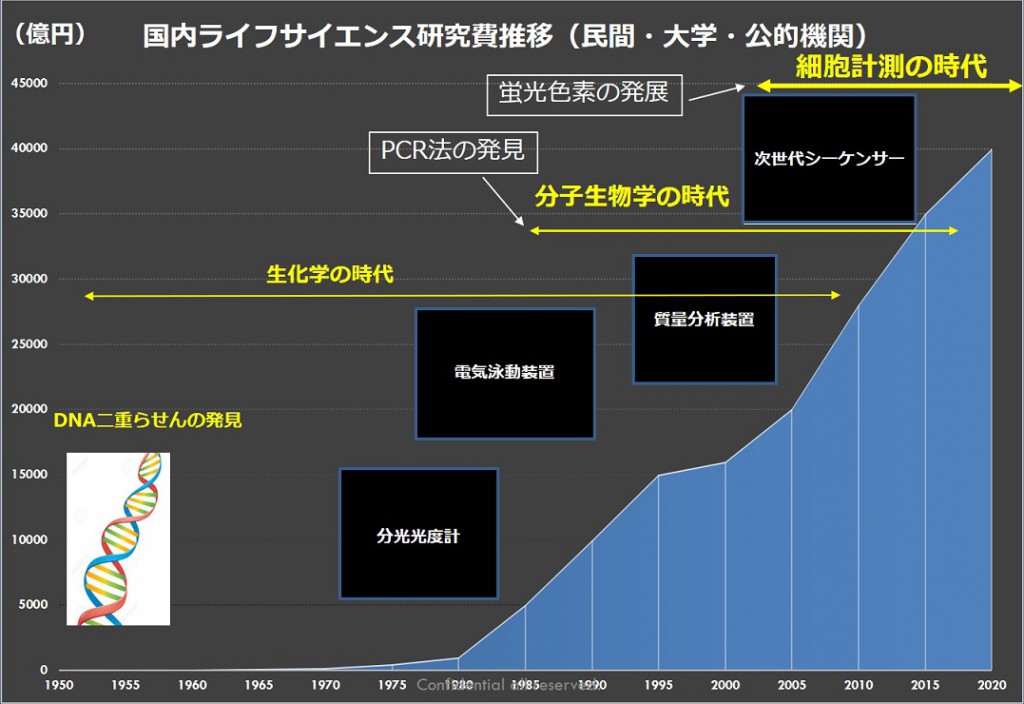
1987年にPCR(Polymerase Chain Reaction)法が報告されて以来、バイオサイエンス研究はそれまで行われてきた「たんぱく質」や「低分子代謝物」などの直接表現系あるいは機能を持つ化合物を定性・定量するという「生化学的」な研究から、DNAの遺伝子配列やRNAの転写量を調べる「分子生物学的」な研究へと急激に移行しました(図18)
図18:国内ライフサイエンス研究費の推移
このように急激に移行した理由は、PCR法により短時間で遺伝子を指数関数的に増やすことが可能となり検出感度が大幅に上昇したからです{25年前のたんぱく質の検出感度:nmol~pmol(10の14~11乗個)に対して、DNAやRNAの検出感度:1~数個}
このことから遺伝子を解析することにより病気のメカニズムが解明され、創薬などに大きく寄与することが期待されましたが、患者数の多いがんや他の慢性疾患における発症のメカニズムは全くと言って良いほど解明されておりません。なぜなら、従来世界中で行われてきた分子生物学的な研究は、既に病気となったかどうかの”結果”を調べるための”証拠”を見つける方法であり、病気になるメカニズムを調べる方法では無いからです。
しかしながら、これらの研究を継続的に行ってきたおかげで病気のマーカー(証拠)は数多く見つかり、現在はかなり初期の段階であっても病気を言い当てられるようになりました。ただ、メカニズムをを知るには「なぜ?どのようにして病気になったか?」が重要であり、それを知るためには「細胞が変化を起こす瞬間の観察」とその時の「細胞がさらされている外部・内部環境」を調べることが必要となります。
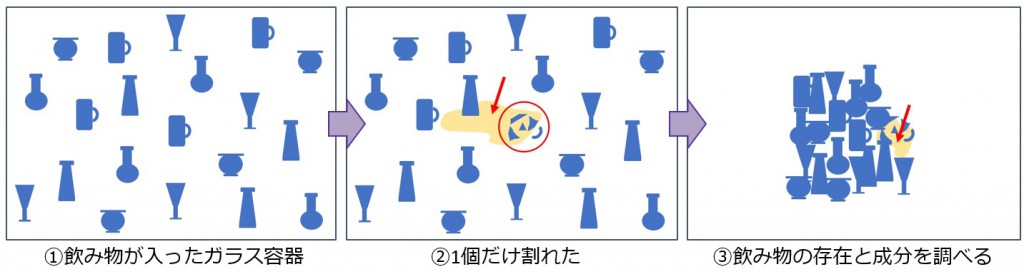
例えば机の上にガラス容器があって中にジュースが入っていたとします(図19)これが何かの拍子に割れてしまい中身がこぼれたとしたとき、少し経ってから破片を見て割れたことに気が付き、こぼれた中身を調べるというのが従来行われてきた研究手法となります。これでは、なぜ割れたのか?(誰かが倒したのか?ボールが飛んできたのか?地震で倒れたのか?=外部環境)という割れたメカニズムについては知る由もありません。
図19 ジュースの成分から割れた原因(メカニズム)を断定するのは困難
また、割れてから時間を経てしまうと成分が蒸発したり分解してしまい、この場合ではジュースという証拠が消えてしまう可能性もあります。
これらの前提を考慮すると、メカニズムを知るための最善の方法は「割れた瞬間を観察すること」と「割れた瞬間または直後に成分を調べること」であり、これを細胞に置き換えると「リアルタイム顕微鏡観察」と「変化中または変化後の迅速測定」だと言えます。
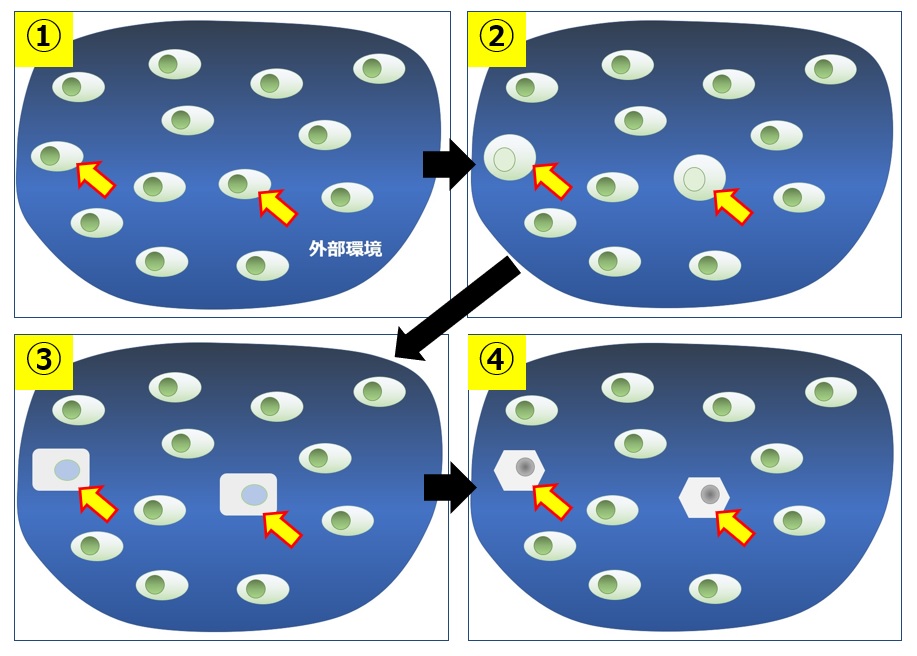
図20では2個の細胞(黄色矢印)がある外部環境で変化していく様子を模式的に記述いたしました。顕微鏡下で培養を行いながら、このような変化が起こる様子をつぶさに観察し、変化が起こり始めたタイミング(②や③)で細胞をピックアップし、迅速に遺伝子解析などを行わなければなりません。細胞内のRNAが分解したり、タンパク質の構造変化や低分子の代謝が起きるため、変化に関与した物質を同定するためにはこのような手法を用いることが特に重要であると考えております。
図20 細胞変化のリアルタイム観察(②や③で1細胞をピッキングする)
近年は図18にあるように蛍光色素の発展と顕微鏡画像取得を中心としたイメージング技術の発展により、研究の主体が細胞計測の時代へと移り変わりました。これらの技術の発展が図20のような刻々と変化する細胞の状態を観察可能にしてきました。これに加えて人の目では分からない非常に微々たる細胞の変化を、ディープラーニングなどを中心とするAI技術を用いる事で変化を予測したり、瞬時に判別したりすることで、従来の研究手法では見つけ出せなかった病気のメカニズムを発見できるものとして期待ができます。
<再生医療における本質的な課題>
2018.1.16~
現在の「医療」は大別すると「治療」「検査・診断」「予防(ワクチン)」「リハビリテーション」などとなり、その中でも「治療」についての具体的な処置としては、「手術」「薬剤投与(西洋医学)」「漢方薬投与(東洋医学)」「放射線治療」「移植」などに分類できます。再生医療はこのうち「移植」に分類され、細胞や臓器を「体内に入れる」という他の治療方法とは異なる手法を行います。これは他の治療方法と比べると非常に大きな違いとなります。
そのような中、iPS細胞(人工多能性幹細胞)の作製方法が2006年に発見され、2017年の3月には第1号の臨床患者に網膜の移植が施されました。しかしながら、元々、ES細胞(胚性幹細胞)やMS細胞(間葉系幹細胞)など、多能性の幹細胞の存在は古くから知られていながら、医療応用はなされておりません。なぜでしょうか。
ES細胞は受精卵が分割し始めたものを用い、そのまま培養すれば個体(生物:例えば胎児)になり得るため、倫理的・宗教的問題を背景に反対者が多い事が理由の一つに挙げられます。また、他の幹細胞に関しても生体適合性(自己免疫応答が起こること)を起因とした拒絶反応を理由に移植が難しいという事が挙げられます。
しかしながら、それ以上の本質的な課題として【Body Plan:ボディプラン】を解明しなければいけないという事が見捨てられている現状があります。
【Body Plan】はまさしく「生物の設計図」の事です。
幹細胞を薬剤などの刺激により、ある臓器になるよう分化誘導を行い、in vitroで培養したものを移植すると最初のうちは機能しますが、ある一定時間が経過すると奇形種が生じたりがんが発生することが経験的に知られておりますが、このメカニズムは分かっておりません。
ヒトゲノムプロジェクトにより、ヒトの全遺伝子配列を読み尽くす計画が進み、2003年に全遺伝子配列解読完了の報告がありました。当時は「これでヒトの設計図が解明された」としきりに言われたものですが、解明されたのは「設計図」ではなく、約22,000個からなる「部品表」でした。その後は「タンパク3000プロジェクト」などにより、この部品を遺伝子組み換え手法を用いて作製、精製し手に入れる努力も行われましたが、個々の機能の全容解明には、これにもまだほど遠い年月が必要だと思われます。
この個々の部品の解明にも増して、設計図となるこれらの部品が必要な時期に必要な場所でつかわれなければなりません。
生物は、その分化・発生時に卵や母体の中でそのその生物が歩んできた進化の過程を一歩一歩経て、現存の姿へ成長していきます。その過程でやはり必要な時期に必要な場所で遺伝子が発現し、タンパク質が機能することで、目なら目の構造になりながら目の位置に配置され、腎臓なら腎臓の構造になりながら腎臓の位置に配置されていきます。この過程こそがまさに【Body Plan】です。
前述で挙げた臨床患者の網膜移植では2011年に報告された【Body Plan】の解明を元に網膜組織が構成され移植がなされています〔9〕。今後、この解明を加速するためには「Single-Individual Micro Cut:SIMC法(1個体微裁断)」の網羅的解析などが必要で、このような手法を用いて解明をしていきたいと考えております。
1個体微裁断網羅的解析を行うために、シリコンブレードアレイというマス目状に裁断刃が並んだ物を用いて、例えばプラナリアのような再生能力が非常に高い小型の動物やマウスの胎児など1個体を10,000分割以上に瞬時に刻みます(図21)
図21 SIMC法:1個体微裁断
これを経次的な変化も考慮して詳細に調べていくことで「なぜこのような場所に目ができるのか?」「なぜこの場所に腎臓ができるのか?」が分かり、このような結果の情報を拾い集めて総合的に判断することが、真の再生医療の応用につながると期待しております。
(2018.4.22)
〔1〕 株式会社ジナリスオミックスGenaport
〔2〕 N.Kawano et al. : Cytologia 76(2) ,2011
〔3〕 「がん超早期診断・治療機器の総合研究開発」(中間評価)第1回分科会 資料7-1(NEDO)
〔4〕 R.I.Amann et al.:Microbiol Rev,59,143-169,1995
〔5〕 「社会保障給付費の推移」(厚生労働省)
〔6〕 平成27年度 子ども・子育て支援推進調査研究事業(厚生労働省)
〔7〕 次世代バイオ医薬品製造技術研究組合
http://www.meti.go.jp/policy/tech_promotion/kenkyuu/saishin/33.pdf
〔8〕 Vascularized and functional human liver from an iPSC-derived organ bud transplant
T.Takebe et al. : Nature 499,481-484,2013
〔9〕 Self-organizing optic-cup morphogenesis in three-dimensional culture
M.Eiraku et al. : Nature 472,51-56,2011