新しく開発中の技術や製品を紹介いたします。
電動シリンジ
このたび、アットドウス株式会社と共同で「電動シリンジ」に関する特許を出願いたしました。
シリンジ(注射器)は医療現場において最も歴史が長く、多方面で使用されている道具です。
この存在は17世紀頃から知られており、現行の形状は19世紀にはほぼ確立したと言われております。
シリンジは下記のような用途で使用されています。
(1)皮下注射(薬剤注射、ワクチン接種、麻酔注射、インスリン注射)
(2)静脈内注射(薬剤注射)
(3)筋肉内注射(薬剤注射、ワクチン接種)
(4)口腔内注射(歯科麻酔注射)
(5)採血
(6)生検用体液採取(がん検診、各種病気の検診)
(7)眼内前房水採取
(8)瀉血(=しゃけつ:うみ、老廃物採取)
このようにシリンジは多くの場面で使用されながら、医師などのユーザーは
超高速PCR マルチプレックス検出システム
〔ポンプレス〕PDMS製マイクロ流体チップ
<〔ポンプレス〕のメリット>
研究分野でマイクロデバイスを用いた医療応用への開発が頻繁に行われ始めるようになったのは西暦2000年前後です。その後、東京大学を始めとする各大学の研究室、理化学研究所や産業技術総合研究所などの公的研究機関、大企業、中小、ベンチャー企業など様々な研究機関で開発が進められてきました。特に微量の血液や細胞溶液を流すことで病気の診断が出来ることを目指したマイクロ流体デバイスや、オイル中に水滴を形成するドロップレットの作製を目指したドロップレットチップが開発されてきました。
しかしながら、2021年現在におきまして、予想に反しこれらの診断チップは市場に採用されておりません。その理由を検証しますと
①チップに液体を流し込む装置(ポンプシステム)の開発が難しい
②同装置のコストが高く市場に受け入れられない
③元々チップ自体が高額で、量産に進むために必要な事前検証(セミプロセス)における費用が捻出できない(例:研究時において数万円/1枚のチップを1万枚使用して検証を行いたいが、その予算は無い)
④PDMSチップは鋳型に対しての転写性が高いため理想と同じ構造を作れたが、量産時に汎用樹脂(PS,PP,PMMAなど)に移行した場合、その構造が作れない
⑤PDMSで量産したいが、量産できる会社や設備が無い
などの理由が考えられます。
この課題を解決するために当社は、国内大学機関と共同研究を推し進めることで装置を必要としない〔ポンプレス〕のマイクロ流体チップの開発を進めました。
従来、マイクロ流体チップへ液体を導入するもので一般的なのは、シリンジポンプを利用する場合と圧縮空気をバルブで徐々に開放するシステムが存在します。
シリンジポンプを利用する場合、チューブへの接続が必要となるため、マイクロ流体チップにシリコンチューブを接着したりコネクタを介してフッ素系チューブを接続したりという工夫を行い、その後、導入したい液体サンプルの種類分の台数となるシリンジポンプを準備し、それぞれ液体サンプルをシリンジの先端から吸い込み、シリンジ先端をマイクロ流体チップから来るチューブと接続し、シリンジをモーター装置にセットし、モーターを駆動させることで送液を行っています。
圧縮空気とバルブのシステムを利用する場合、まず高圧チャンバーがあり、その蓋に接続されているチューブから圧縮空気がチャンバー内に流れ込む構造となっています。その蓋を開けて中に液体サンプルが入った容器をセットし、蓋から延びるチューブの先端を容器内の空間に配置し、高圧チャンバーを閉じます。こちらも各液体サンプルの種類分、装置を準備しそれぞれセットを行った後に、バルブの開閉による制御で送液を行います。
いずれの装置にしても、それぞれ1台分の体積や重さはマイクロ流体チップに比べていずれも数百倍~数千倍になり、そのポンプシステムが実験部材のほとんどを占めることになります。また装置は高額です。
加えて、マイクロ流体チップに複数のチューブから同時に液体を流すと流路内に気泡を噛んでしまい、流体の流れを変えてしまうことで実験結果に悪影響を及ぼすことが頻繁に発生します。このため、最初に気泡を抜く作業を行うのが一般的ですが、そのために使用する試薬の量が多く、これがデッドボリュームとなります。
このような課題を解決するために、当社ではマイクロ流体チップ自体を減圧・脱気し高効率で送液を行うことが可能な技術を、国内のアカデミア機関から導入いたしました。
本技術を用いると、コネクタやチューブなどを接続する手間も無くなりコストも下がるため、今までより多くの枚数を用いてマイクロ流体チップの評価を行うことが可能となります。
また、実際に市場化を見込んだ際に、当社が保有する真空パックのノウハウを用いることで、病院やクリニックなどあらゆる現場で手軽に使用することが可能となるため、実現性が高くなります。
<Well makes drops = Wdro(ウドロ)法>
上述のような背景の中、当社は共同研究先の期間とほぼ同時期に新しいマイクロドロップレット製造技術を発見し、共同で特許を出願いたしました。3
まずは、従来行われてきたT字や十字型の分岐流路を使用してマイクロドロップレットを製造している動画を見てみます。
マイクロ流体チップの分岐流路を用いてマイクロドロップを製造する際に、流路設計時にレイノルズ数や流路断面積、流路長などの数値を用いますが、これらの数値を持ってマイクロ流路の設計を行っても、実験時の気温、湿度、材質、液体の種類などによって刻々と条件が変わってしまいます。これは分岐流路の形状が複雑になればなるほど顕著に現れますが、それを上述の送液装置の流量調整をもって最適化を行います。
しかしながら、このような調整には高度なノウハウが必要となるため本来の生物学的実験から離れて、流体力学や液体操作技術を駆使しなければならなくなるなど、目的からかけ離れて行ってしまうことがあります。
このように、従来のマイクロ流体チップによるマイクロドロップレット製造には多くの課題が存在するため、高い必要性がありながらライフサイエンス研究の多くの研究者は使用したことが少ないのが現状でした。
このような背景の中、当社と共同研究先はマイクロドロップレットの製造が従来の分岐流路部ではなくマイクロ流路と液滴貯留部の境界で高速に行われることを見出しました。
このようなマイクロドロップレット製造チップを真空パックにして供給し、1カ月後に開封して使用してもマイクロドロップレットが製造できることを実証しております。
改めて本技術のメリットをまとめますと
・高額な装置を用いない
・マイクロ流体チップへチューブを介して面倒な接続をする必要が無い
・デッドボリュームを最小限に低減できる
・試薬代が安価に済む(1/10以下)
・分岐流路を用いず、単純な1本の流路だけでよい
・高速にマイクロドロップレットが製造される
・マイクロ流体力学の知識が無くても手軽に実験できる
・真空パックに包装されており、使いたいときに
場所を問わず使用できる
本技術はバイオテクノロジーの研究に限らず、化粧品、食品、化成品、医薬品のエマルジョンを作製する際の研究開発をも大きく発展させる可能性を秘めております。
生体内細胞溶解回収システム
生体内に腫瘍が出来た場合、現在は「外科的手術/化学療法による薬剤/放射線療法」などで除去を行います。外科的手術の場合、開腹・開胸などメスで皮膚や筋肉を切開後に腫瘍を取り除きます。脳腫瘍の場合には硬膜の切開を必要とすることもあります。あるいは、近年は腹腔鏡手術具の発展が著しく、皮膚に小さい穴を開けるだけでファイバーを挿入し、腫瘍を取り除くことも可能となっています。化学療法については、DDS(ドラッグデリバリーシステム)や標的分子薬の研究がなされ、服薬や静脈投与であっても極力腫瘍のみに効果をもたらし縮小させるという開発が進められています。放射線療法は定位放射線療法などピンポイントで生体内の腫瘍にのみ効果をもたらし縮小させるという手法も用いられることがあります。
しかしながら、腫瘍、特にがんはこのような医療技術の発展努力にもかかわらず、患者数は世界的に増加傾向で、今のところ減少する気配はなく再発するケースも多く存在します。理由といたしましては、腫瘍を上述の手法で取り除いても「転移」といわれる現象によって新たな部位に腫瘍が生じてしまい、他の臓器や骨に癒着し、血管を張り巡らせ出血するリスクを高めるため、外科的手術では取り除けない場所に生じる場合や、それを取り除くために更に毒性の強い抗がん剤を用いなければならないからです。こうなると、いたちごっこが始まり、きりがなく、最終的にはその毒性によって生体が弱って亡くなってしまうか、もしくは腫瘍の張りの痛みに耐えられず麻薬を用いて亡くなることが現実として多くあります。
医療現場では、注射針やカテーテルから少しずつ抗がん剤を含んだ薬液等を投与する点滴も採用されています。点滴におきましては、輸液容器から点滴用のチューブを伝って流れる輸液に、三方活栓を介してシリンジポンプから薬液を混入させる手法が取られています。この場合シリンジポンプは、薬液の流量を任意に設定することができます。このような手法を用いて静脈から抗がん剤を投与しても薬剤が腫瘍やがんに到達できるとは限りません。
腫瘍は細胞の塊ですので、細胞を溶解する薬剤を導入すれば小さくできる可能性がありますが、当然そのような薬剤は腫瘍以外の正常な細胞も溶解してしまう可能性があり、毒性があること、また溶解した細胞液自身が少量であれば体内の代謝で処理できるかもしれませんが、大量になる場合には毒性となることも想定されます。これを解決するためには溶解液を微量に注入しながら、注入部付近の溶解した細胞溶液をすぐに回収する機構が必要となってきます。
溶液を回収するためには陰圧にする必要がありますが、加圧に比べ陰圧を制御することは比較的困難です。「真空度の高い状態」を作り出しても何かを吸い始めるとそこで真空では無くなるため真空度を高く保つことは難しいです。加圧の場合押す力を強くすれば原理的には限りなく強くできますが、陰圧の力には限りがあり、詰まったときに陰圧だけでは対処できない場合が多くあります。このような状況ではありますが、真空度を高く保つうえで最も重要な指標は「容積を小さくする」ことです。
現状の一般的なシリンジポンプなどはポンプ自身のサイズが大きいため、いつでも患者のすぐ脇に置くことができません。そのため、ポンプから点滴チューブまでの距離が長くなり、チューブ内の内圧を低く保つことが難しいという状況があります。
上述のような課題に対して、患者に密着させながら生体内の局所に細胞溶解液を注入した後、短時間で懸濁液(薬剤、細胞溶解液、細胞溶解液で溶解された細胞などを含む)を吸引できる生体用吸引具を開発いたしました。今後、動物実験を経て実際の患者で応用できるように更なる開発を進めていきます。
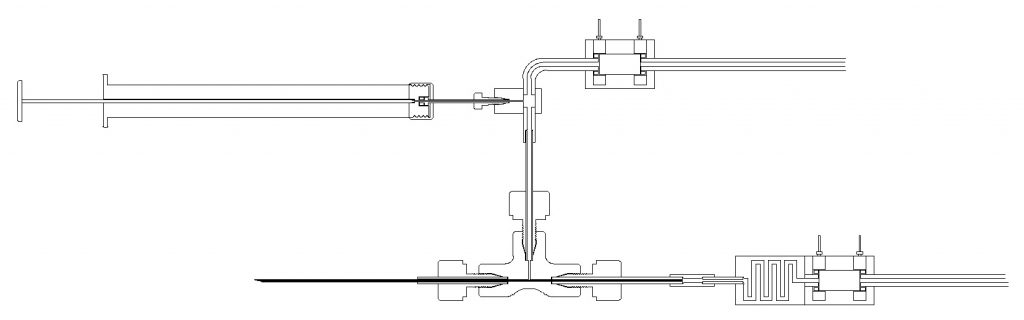
22ゲージ(外径0.81 x 内径0.51) の中に外径200μmの針を挿入した二重針の先端画像
図中、右のポンプから押し出された薬剤が内針の中を通り吐出され、図中、上のポンプを吸引駆動すると内針と外針の間から溶液を吸引することが可能です。
内針と外針から異なる種類の溶液を任意の流速で吐出して、体内で混ぜることもできます。

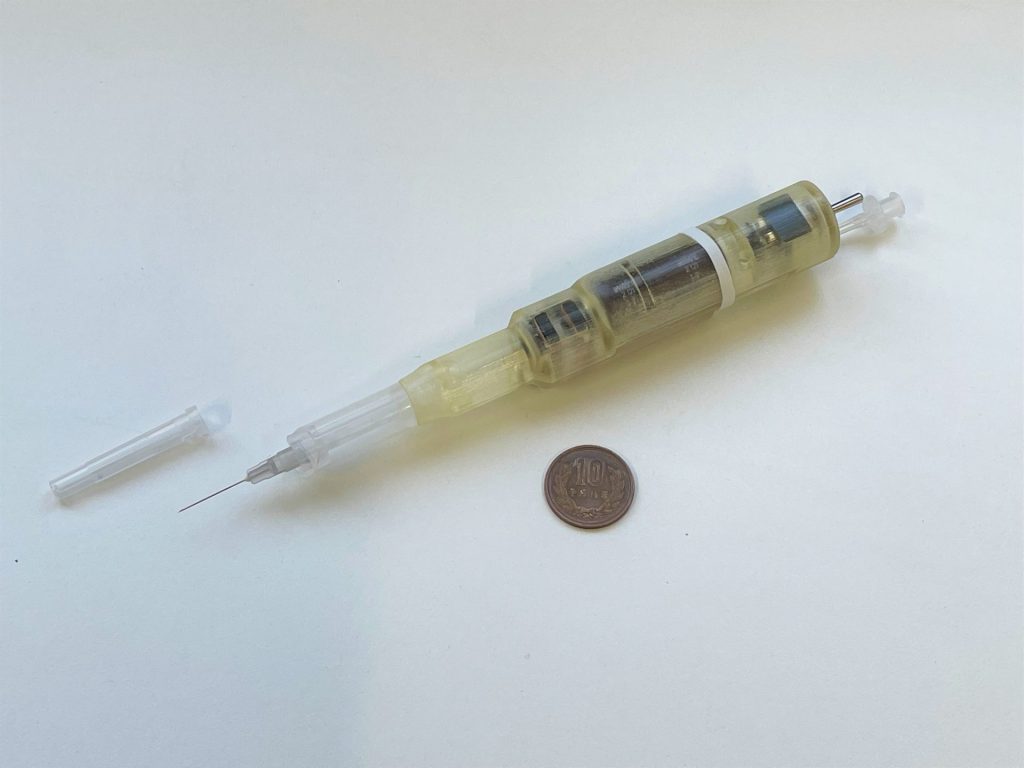 新技術を用いた電動シリンジ(コンデンサ+EOP)
新技術を用いた電動シリンジ(コンデンサ+EOP)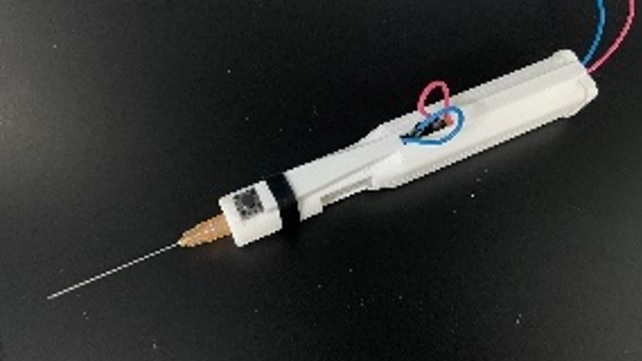 旧 電動シリンジ(電気ケーブルが付随する)
旧 電動シリンジ(電気ケーブルが付随する)